Capteur de pression capacitif portable pour la collecte de signaux physiologiques humains
Capteur de pression capacitif portable pour la collecte de signaux physiologiques humains
Ces dernières années, les capteurs de pression à haute sensibilité dotés de flexibilité, de biocompatibilité et d'extensibilité ont attiré une large attention dans les domaines des appareils électroniques portables et des peaux intelligentes. Cependant, c'est un défi considérable d'obtenir à la fois une sensibilité élevée et un faible coût du capteur, et d'obtenir la meilleure stabilité mécanique et une limite de détection ultra-basse pour une utilisation dans des équipements de surveillance de signaux physiologiques délicats. En réponse aux problèmes ci-dessus, cet article rapporte une méthode de préparation simple d'un capteur de pression capacitif (CPS) haute sensibilité et haute fiabilité pour la mesure de pression ultra-basse. TrFE) échafaudage composite en nanofibres (CNS) pris en sandwich entre des électrodes biocompatibles d'acide poly(3,4-éthylènedioxythiophène) polystyrène sulfonique (PEDOT:PSS)/polydiméthylsiloxane (PDMS) Entre comme couche diélectrique. Le capteur préparé a une sensibilité élevée de 0,51 kPa-1 et une limite de détection minimale de 1,5 Pa. De plus, il peut également réaliser une détection linéaire dans une large plage de pression (0-400 kPa) et atteindre une fiabilité élevée pendant 10 000 cycles même à ultra haute pression (supérieure à 167 kPa). Par rapport à l'échafaudage de nanofibres PVDF-TrFE d'origine, la sensibilité du capteur à base de nanofibres peut être améliorée en chargeant avec du MXene, augmentant ainsi la constante diélectrique à 40 et réduisant le module de compression à 58 %. Ce capteur peut déterminer la santé des patients en surveillant les signaux physiologiques (fréquence du pouls, respiration, mouvements musculaires et contractions oculaires) et est un bon candidat pour la prochaine génération de dispositifs d'interface homme-machine. il peut également réaliser une détection linéaire dans une large plage de pression (0-400 kPa) et atteindre une fiabilité élevée pendant 10 000 cycles, même à très haute pression (supérieure à 167 kPa). Par rapport à l'échafaudage de nanofibres PVDF-TrFE d'origine, la sensibilité du capteur à base de nanofibres peut être améliorée en chargeant avec du MXene, augmentant ainsi la constante diélectrique à 40 et réduisant le module de compression à 58 %. Ce capteur peut déterminer la santé des patients en surveillant les signaux physiologiques (fréquence du pouls, respiration, mouvements musculaires et contractions oculaires) et est un bon candidat pour la prochaine génération de dispositifs d'interface homme-machine. il peut également réaliser une détection linéaire dans une large plage de pression (0-400 kPa) et atteindre une fiabilité élevée pendant 10 000 cycles, même à très haute pression (supérieure à 167 kPa). Par rapport à l'échafaudage de nanofibres PVDF-TrFE d'origine, la sensibilité du capteur à base de nanofibres peut être améliorée en chargeant avec du MXene, augmentant ainsi la constante diélectrique à 40 et réduisant le module de compression à 58 %. Ce capteur peut déterminer la santé des patients en surveillant les signaux physiologiques (fréquence du pouls, respiration, mouvements musculaires et contractions oculaires) et est un bon candidat pour la prochaine génération de dispositifs d'interface homme-machine. Par rapport à l'échafaudage de nanofibres PVDF-TrFE d'origine, la sensibilité du capteur à base de nanofibres peut être améliorée en chargeant avec du MXene, augmentant ainsi la constante diélectrique à 40 et réduisant le module de compression à 58 %. Ce capteur peut déterminer la santé des patients en surveillant les signaux physiologiques (fréquence du pouls, respiration, mouvements musculaires et contractions oculaires) et est un bon candidat pour la prochaine génération de dispositifs d'interface homme-machine. Par rapport à l'échafaudage de nanofibres PVDF-TrFE d'origine, la sensibilité du capteur à base de nanofibres peut être améliorée en chargeant avec du MXene, augmentant ainsi la constante diélectrique à 40 et réduisant le module de compression à 58 %. Ce capteur peut déterminer la santé des patients en surveillant les signaux physiologiques (fréquence du pouls, respiration, mouvements musculaires et contractions oculaires) et est un bon candidat pour la prochaine génération de dispositifs d'interface homme-machine.
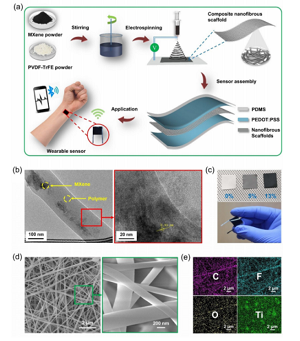
Figure 1. Processus de préparation et structure du capteur de pression basé sur le CNS. (A) Montrez le diagramme schématique du processus de préparation du capteur de pression basé sur le CNS. (B) Image TEM du SNC, montrant un nanoflocon de MXene monocouche et multicouche. L'encart est un MET haute résolution montrant l'espacement intercouche de 0,93 nm correspondant au plan MXene (002). (C) La photo montre le SNC de différentes concentrations de MXene et le capteur fabriqué. (D) Image FESEM du SNC. L'encart montre la morphologie à un grossissement plus élevé. (E) Le diagramme EDS des nanofibres composites montre les éléments C, F, O et Ti.
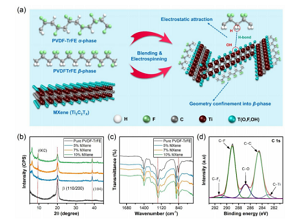
Figure 2. Caractéristiques schématiques et de surface du SNC. (A) Un diagramme schématique montrant la synergie obtenue après l'introduction de MXene dans la matrice polymère. (B, c) Analyse XRD et FTIR du SNC à diverses concentrations de MXene. (D) Spectre XPS de la région C 1s du SNC contenant 5 % en poids de concentration de MXène.
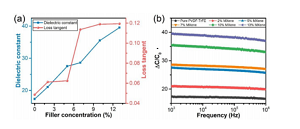
Figure 3. Caractéristiques électriques de différents échantillons (a) La constante diélectrique et la tangente de perte du SNC par rapport à la teneur en MXène (en % en poids). (B) Dépendance en fréquence de la constante diélectrique.
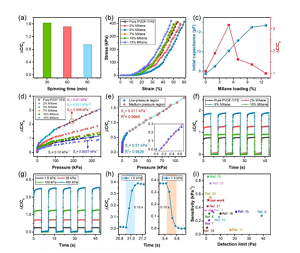
Figure 4. Caractéristiques électromécaniques des capteurs de pression à base de CNS. (A) Comparaison des performances des capteurs à base de CNS basée sur différents temps d'électrofilage. (B) La performance de contrainte-déformation en compression du capteur sous une charge stable avec une distance de compression allant jusqu'à 0,4 mm. (C) La capacité initiale (C0) et le changement relatif (ΔC/C0) du capteur à base de CNS dépendent de la teneur en MXene (en % en poids). (D) Le changement de capacité relative (ΔC/C0) des capteurs à base de CNS contenant des couches diélectriques avec différentes concentrations de MXene (en % en poids) sous une distance de compression constante de 0,4 mm. (E) Un graphique descriptif de C/C0, illustrant la sensibilité à la pression obtenue lorsque la charge de MXene est de 5 % en poids. L'illustration montre la sensibilité du capteur dans la zone de basse pression. (F) Pour différentes concentrations de MXene, la réponse capacitive cyclique (chargement/déchargement) des capteurs à base de CNS à une distance de compression constante de 0,3 mm, et (g) À différentes valeurs de pression de chargement/déchargement, la concentration en MXene est de 5 % en poids de la réponse capacitive cyclique du CNS capteur basé. (H) Temps de réponse et de relaxation dans un cycle de chargement/déchargement avec une pression de 1,5 kPa. (I) Par rapport au rapport précédent, les performances du capteur en termes de sensibilité sont rapportées à des limites de détection basses dans la plage de basse pression.
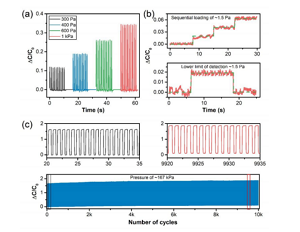
Figure 5. (a) Le changement relatif de la réponse de capacité sous des cycles de chargement et de déchargement à basse tension. (B) Illustrer la limite inférieure de détection (LOD) en chargeant et déchargeant séquentiellement environ 38 mg de riz à grains longs. (C) Test de stabilité cyclique du capteur de pression à base de CNS après 10 000 cycles de chargement et de déchargement sous haute pression d'environ 167 kPa (compression supérieure à 40%). L'encart montre le cycle sélectionné au début et à la fin du test de stabilité.
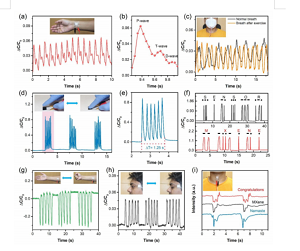
Figure 6. L'application de capteurs basés sur le CNS dans la surveillance continue et en temps réel des signaux physiologiques humains. (A) Surveillance en temps réel de l'onde de pouls artériel. Illustration : Photo du capteur fixé sur la peau du poignet. (B) Une vue agrandie d'une seule forme d'onde d'impulsion, y compris des informations détaillées sur ses pics caractéristiques. (C) Surveillez la respiration avant et après l'exercice. Illustration : Une photo d'un capteur attaché à un masque pour surveiller la fréquence respiratoire. (D) Le diagramme montre que le capteur simule le tapotement du doigt à une fréquence de tremblement statique de 4,8 Hz pour détecter la maladie de Parkinson primaire. Illustration : Une photo qui imite un doigt tapotant la surface du capteur à une fréquence constante. (E) Une image agrandie qui simule une percussion à une fréquence de tremblement spécifique de 4,8 Hz. (F) Une pression courte et longue sur le capteur peut générer un signal de code Morse international. (G) Surveiller la contraction et l'expansion musculaire en ouvrant et fermant le poing de manière réversible. Illustration : Photo du capteur fixé sur les muscles abdominaux du poignet. (H) Surveillez le signal généré par la vibration des muscles oculaires pendant les contractions oculaires. Illustration : Une photo du capteur fixé sur la peau de l'œil. (I) La capacité du capteur à reconnaître différents sons avec des formes d'onde répétitives et différentes. Illustration : Photo du capteur fixé sur l'épiderme de la gorge. (H) Surveillez le signal généré par la vibration des muscles oculaires pendant les contractions oculaires. Illustration : Une photo du capteur fixé sur la peau de l'œil. (I) La capacité du capteur à reconnaître différents sons avec des formes d'onde répétitives et différentes. Illustration : Photo du capteur fixé sur l'épiderme de la gorge. (H) Surveillez le signal généré par la vibration des muscles oculaires pendant les contractions oculaires. Illustration : Une photo du capteur fixé sur la peau de l'œil. (I) La capacité du capteur à reconnaître différents sons avec des formes d'onde répétitives et différentes. Illustration : Photo du capteur fixé sur l'épiderme de la gorge.




